Isi
Persentase massa menentukan persentase setiap unsur yang membentuk suatu senyawa kimia. Untuk mencari nilai ini, Anda membutuhkan massa molar unsur-unsur senyawa dalam gram / mol atau jumlah gram yang digunakan untuk membuat larutan. Persentase massa dapat dihitung dengan cara sederhana menggunakan rumus dasar yang membagi massa unsur (atau zat terlarut) dengan massa senyawa (atau larutan).
Langkah
Metode 1 dari 2: Menemukan persentase massa dengan massa yang diberikan
- Tentukan persamaan untuk persentase massa suatu senyawa. Rumus dasar untuk suatu senyawa adalah: persentase massa = () x 100. Anda harus mengalikan hasilnya dengan 100 di akhir untuk menyatakan nilai sebagai persentase.
- Massa senyawa kimia yang Anda minati adalah massa yang diberikan dalam soal. Jika nilai ini tidak tersedia, lihat Metode berikut dan pelajari cara mencari persentase massa jika tidak ada massa.
- Massa total suatu senyawa dihitung dengan menjumlahkan massa semua elemen yang digunakan untuk membuat senyawa atau larutan.
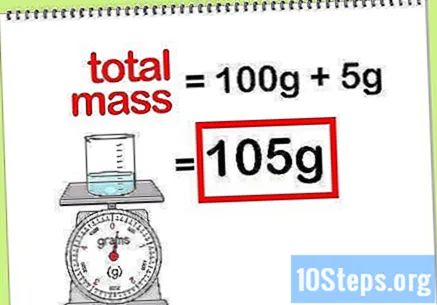
Hitung massa total senyawa. Saat Anda mengetahui nilai massa semua unsur atau senyawa yang ditambahkan, Anda hanya perlu menjumlahkannya untuk menghitung massa senyawa atau solusi akhirnya. Nilai ini akan menjadi penyebut dalam perhitungan persentase massa.- Sebagai contoh: Berapa persentase massa 5 g natrium hidroksida yang terlarut dalam 100 g air?
- Massa total senyawa adalah jumlah natrium peroksida ditambah jumlah air: 100 g + 5 g, dengan total massa 105 g.

Identifikasi massa bahan kimia yang dimaksud. Saat Anda perlu mencari file persentase massa, soal meminta Anda mencari massa suatu unsur (unsur yang dimaksud) sebagai persentase dari massa total semua unsur. Catat massa elemen yang dimaksud. Nilai ini akan menjadi pembilang dalam perhitungan persentase massa.- Misalnya massa unsur adalah 5 g natrium hidroksida.
- Gantikan variabel dalam rumus persentase massa. Setelah menentukan nilai untuk setiap variabel, gantilah dalam persamaan.
- Misalnya: persentase massa = () x 100 = () x 100.

Hitung massa persentase. Sekarang persamaan sudah terbentuk, selesaikan saja untuk menghitung persentase massa. Bagilah massa unsur dengan massa total senyawa dan kalikan dengan 100. Hasilnya adalah persentase massa unsur kimianya.- Misalnya: () x 100 = 0,04761 x 100 = 4,751%. Jadi, persentase massa 5 g natrium hidroksida yang terlarut dalam 100 g air adalah 4,751%.
Metode 2 dari 2: Menemukan persentase massa dengan massa yang tidak diberikan
- Tentukan persamaan untuk persentase massa suatu senyawa. Rumus dasar untuk persentase massa suatu senyawa adalah: persentase massa = () x 100. Anda harus mengalikan hasilnya dengan 100 di akhir untuk menyatakan nilai-nilai tersebut sebagai persentase.
- Jika Anda tidak mengetahui nilai massanya, Anda dapat mencari persentase massa suatu unsur senyawa menggunakan massa molar.
- Sebagai contoh: Berapa persentase massa hidrogen dalam molekul air?.
Tulis rumus kimia. Jika rumus kimia untuk setiap senyawa tidak tersedia, Anda harus menuliskannya. Jika tidak, lanjutkan ke Langkah "Temukan massa setiap elemen".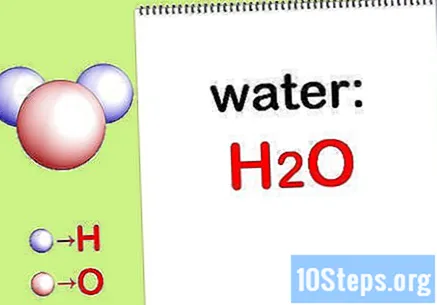
- Misalnya tulis rumus kimia air: H2ITU.
Temukan massa setiap elemen dalam senyawa. Carilah berat molekul setiap unsur rumus kimianya dengan mengacu pada tabel periodik. Umumnya, massa suatu unsur dapat ditemukan di bawah simbol unsur kimia. Perhatikan massa setiap elemen senyawa.
- Misalnya, massa molekul oksigen adalah 15,9994, dan hidrogen adalah 1,0079.
Kalikan massa dengan rasio molar. Identifikasi berapa mol setiap unsur dalam senyawa kimia. Jumlah mol ditentukan oleh jumlah senyawa yang disubscribe. Kalikan massa molekul setiap elemen dengan rasio molar.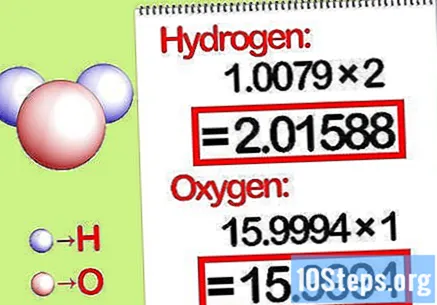
- Misalnya perbandingan molar hidrogen terhadap oksigen dalam air adalah 2: 1. Oleh karena itu, kalikan berat molekul hidrogen dengan dua (1,00794 X 2 = 2,01588) dan biarkan berat molekul oksigen apa adanya (15,9994).
Hitung massa total senyawa. Tambahkan massa total semua elemen senyawa. Dengan menggunakan massa yang dihitung dengan rasio molar, dimungkinkan untuk menghitung massa total senyawa. Angka ini akan menjadi penyebut dari persamaan persentase massa.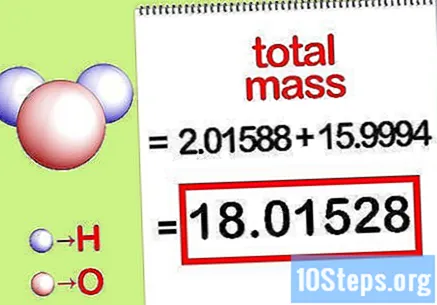
- Misalnya, tambahkan 2.01588 g / mol (massa dua mol atom hidrogen) dengan 15,9994 g / mol (massa satu mol atom oksigen) dan dapatkan 18,01528 g / mol.
Identifikasi massa elemen yang dimaksud. Saat Anda perlu mencari file persentase massa, soal ini ingin Anda mencari massa suatu unsur tertentu dalam suatu senyawa sebagai persentase dari massa total semua unsur. Identifikasi massa elemen yang dimaksud dan tuliskan. Ini adalah nilai massa yang dihitung menggunakan rasio molar. Nilai ini adalah pembilang dari persamaan massa persentase.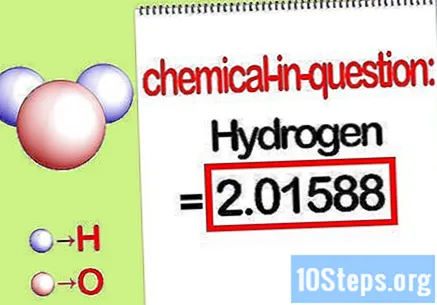
- Misalnya, massa hidrogen dari senyawa tersebut adalah 2,01588 g / mol (massa dua mol atom hidrogen).
- Gantikan variabel dalam rumus persentase massa. Setelah menentukan nilai untuk setiap variabel, gantilah dalam persamaan yang ditentukan pada langkah pertama: persentase massa = () x 100.
- Misalnya: persentase massa = () x 100 = () x 100.
Hitung massa persentase. Sekarang persamaan sudah terbentuk, selesaikan saja untuk menghitung persentase massa. Bagilah massa unsur dengan massa total senyawa dan kalikan dengan 100. Hasilnya adalah persentase massa unsur kimianya.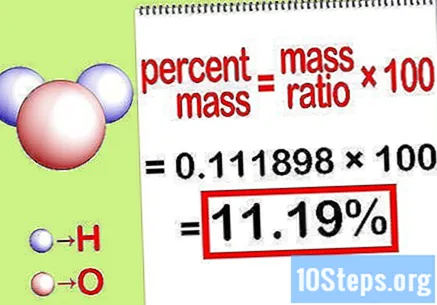
- Misalnya, persentase massa = () x 100 = 0,111189 x 100 = 11,18%. Jadi, persentase massa atom hidrogen dalam sebuah molekul air adalah 11,18%.